Etude de phase 3 multicentrique, internationale (219 sites dans 40 pays), randomisée, en double aveugle, contrôlée vs placebo.
Objectif de l'étude1,2
Évaluer l’efficacité et la tolérance de Cosentyx® versus placebo chez des patients adultes présentant une HS modérée à sévère et nécessitant un traitement par biothérapie.
Schéma de l'étude1,2
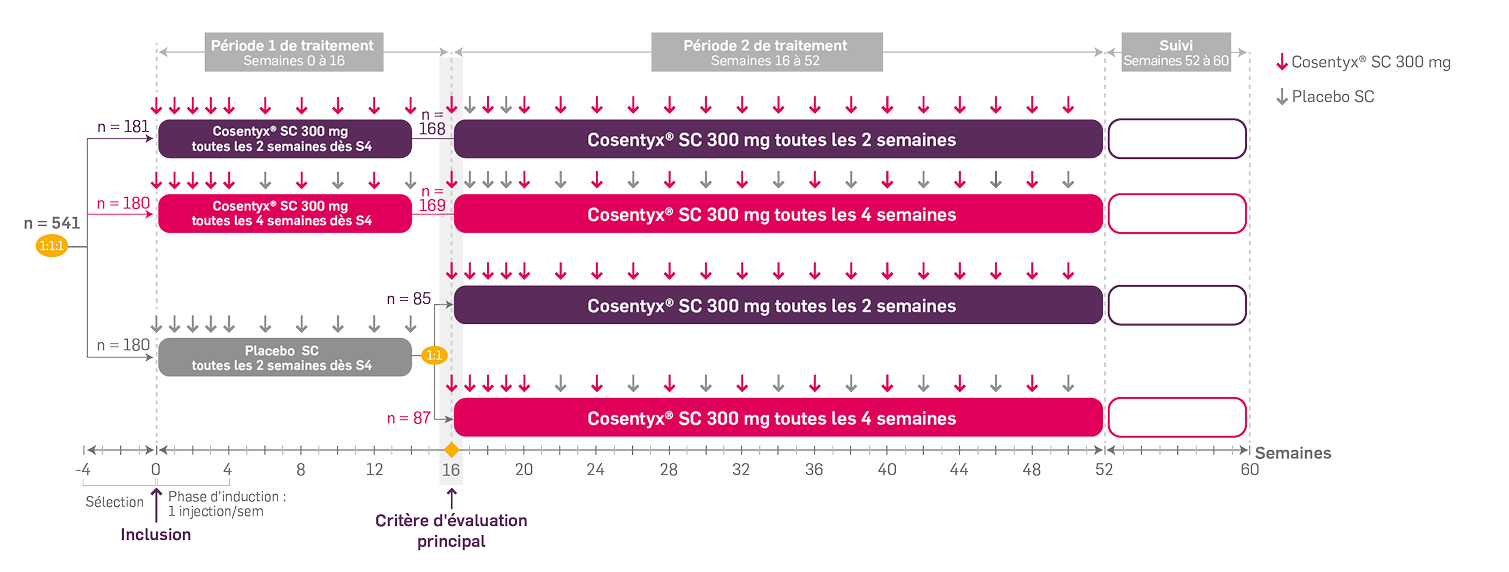
Critères d’inclusion1,2
- Patients ≥ 18 ans atteints d’HS modérée à sévère (définie par au moins 5 lésions inflammatoires affectant au moins 2 régions anatomiques distinctes) depuis au moins 1 an
- Utilisation quotidienne d’antiseptiques topiques en vente libre sur les régions affectées par les lésions de l’HS pendant toute la durée de l’étude
Principaux critères d’exclusion2
- ≥ 20 fistules à la randomisation
- Une pathologie active en cours nécessitant un traitement non autorisé pendant l’étude (ex : traitement biologique immunomodulateur systémique, vaccins vivants ou autres traitements expérimentaux)
Critères d’évaluation1,2
Critère principal
- Pourcentage de patients répondeurs au HiSCR 50 (réduction du score HiSCR ≥ 50 % sans augmentation du nombre d’abcès et/ou de fistules drainantes par rapport à l’inclusion) à la semaine 16
Critères secondaires
- Variation moyenne en pourcentage du nombre d’abcès et nodules par rapport à l’inclusion, à la semaine 16
- Pourcentage de patients présentant des poussées (une poussée étant définie par une augmentation d’au moins 25 % du nombre d’abcès et de nodules avec une augmentation minimale de 2 AN par rapport à la randomisation) au cours des 16 semaines de traitement
- Pourcentage de patients répondeurs au NRS 30 à la semaine 16 parmi les patients présentant un score NRS 30 ≥ 3 à la randomisation (inclusion), sur les données poolées des études SUNSHINE et SUNRISE. Une réponse NRS 30 étant définie par une diminution d’au moins 30 % et d’au moins 2 unités du score NRS par rapport à la randomisation de la douleur cutanée dans l’Evaluation Globale de cette dernière par le patient.
Critères exploratoires prédéfinis
- Pourcentage de patients répondeurs au DLQI (défini par une diminution d’au moins 5 points par rapport à la randomisation)
- Évolution moyenne du score EQ-5D à la semaine 16
- HiSCR 50, évolution du nombre d’abcès et de nodules inflammatoires, nombre de poussées, NRS 30, répondeurs DLQI et score EQ-5D à la semaine 52
- Sécurité d’emploi et de tolérance, surveillance des évènements indésirables, examens cliniques, signes vitaux et évaluations biologiques au cours des 52 semaines
Caractéristiques des patients à l’inclusion2
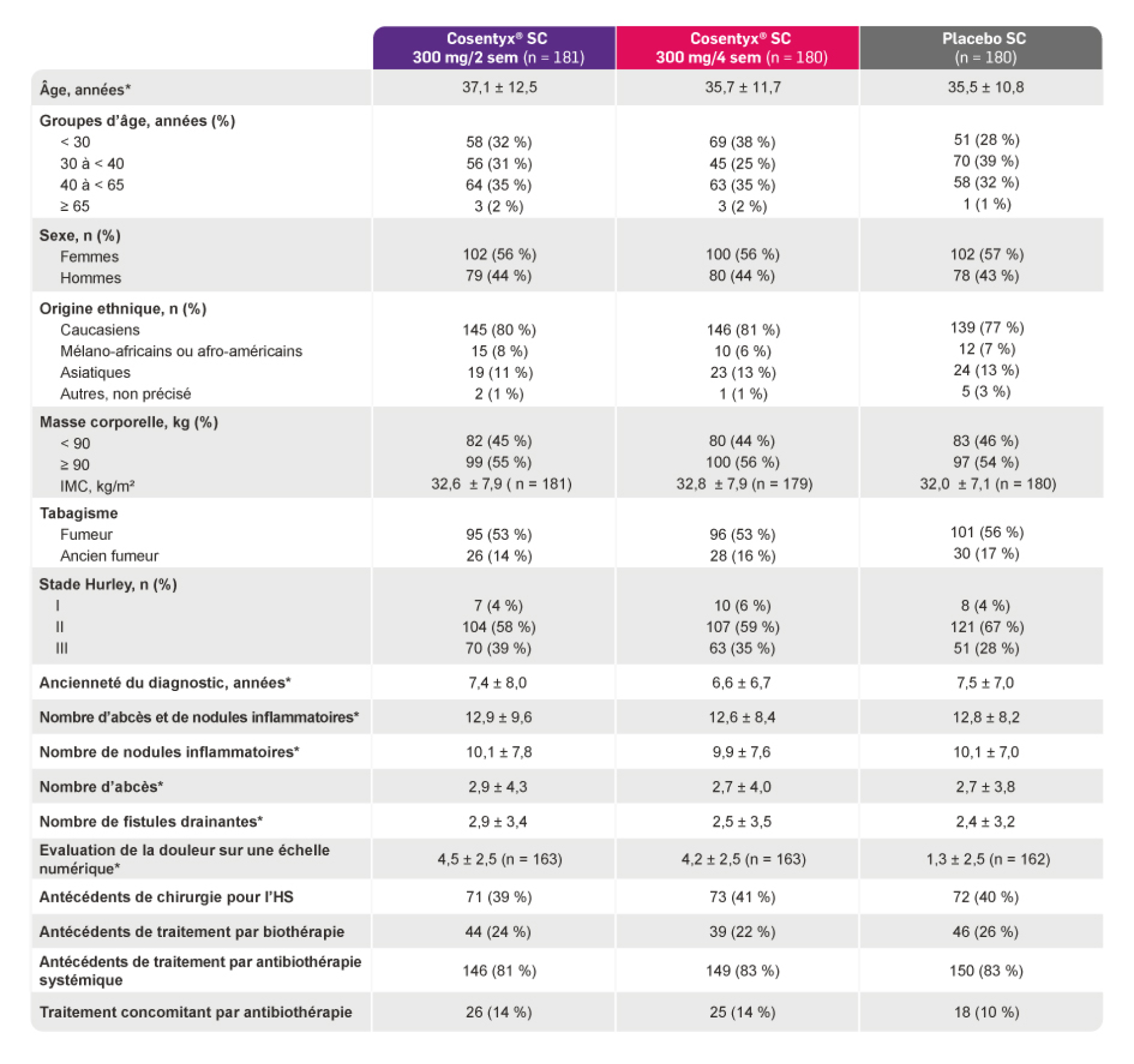
* Les valeurs plus/moins correspondent aux moyennes ± l’écart-type.