En raison de la pathogénèse des maladies inflammatoires à médiation immunitaire, ces patients sont plus sensibles aux infections.
Cependant, sous Cosentyx® :
- Aucune augmentation du risque d’infections virales versus placebo n’a été observée à court terme
- Taux d’incidence des infections virales généralement comparables à long terme
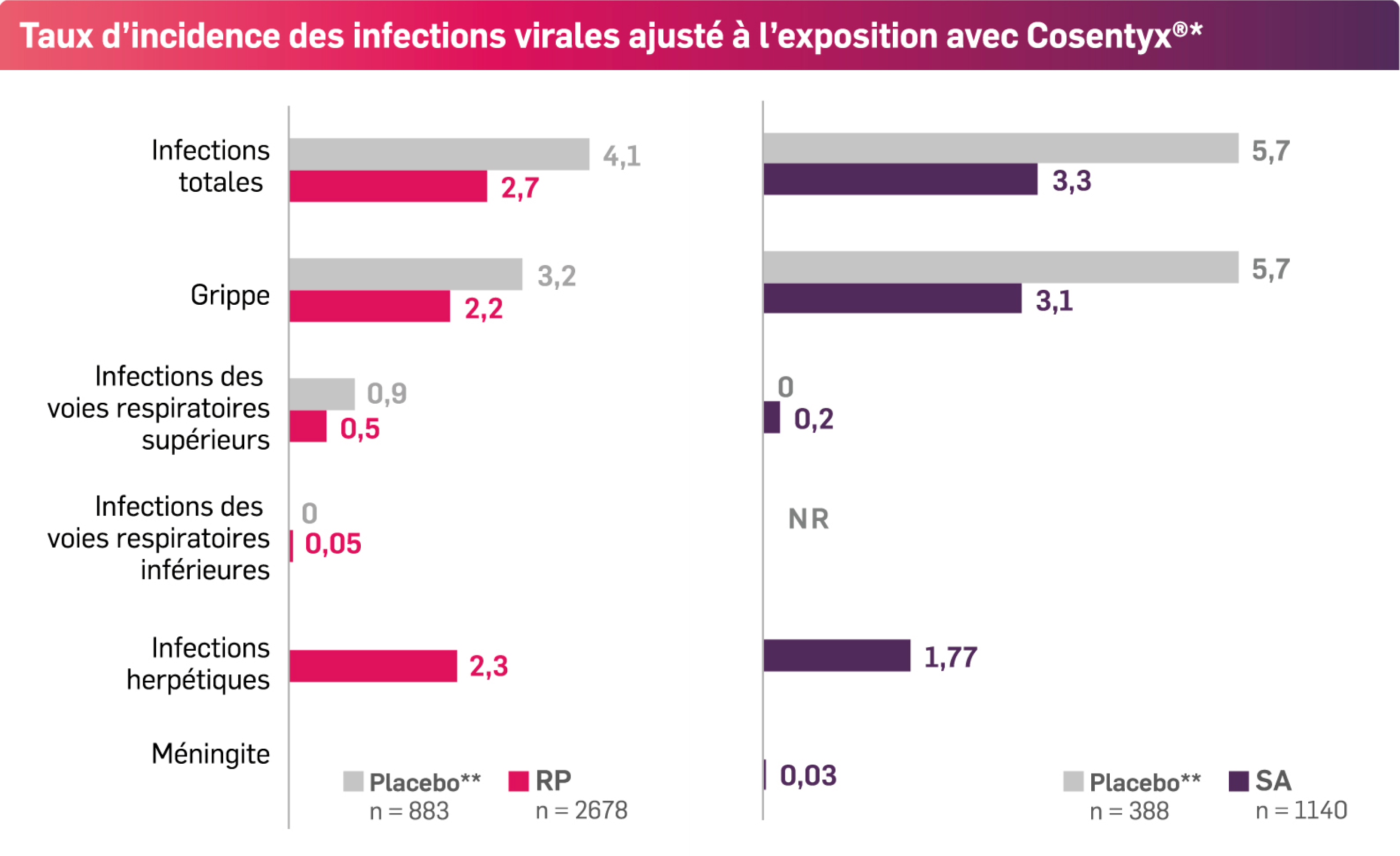
- La grippe était l’infection virale la plus fréquente
- Aucune relation dose-réponse pour les événements lié à la tolérance
* Les schémas posologiques comprenaient le secukinumab par voie intraveineuse (jusqu’à 10 mg/kg) et sous-cutanée (75, 150 ou 300 mg).
** La période de contrôle par placebo dans les études incluses dans l’analyse groupée allait jusqu’à la semaine 16/24. Données Novartis dans le dossier de mai 2020.
Les analyses de sécurité ont inclus tous les patients ayant reçu ≥1 dose de secukinumab (y compris les switchers placebo).
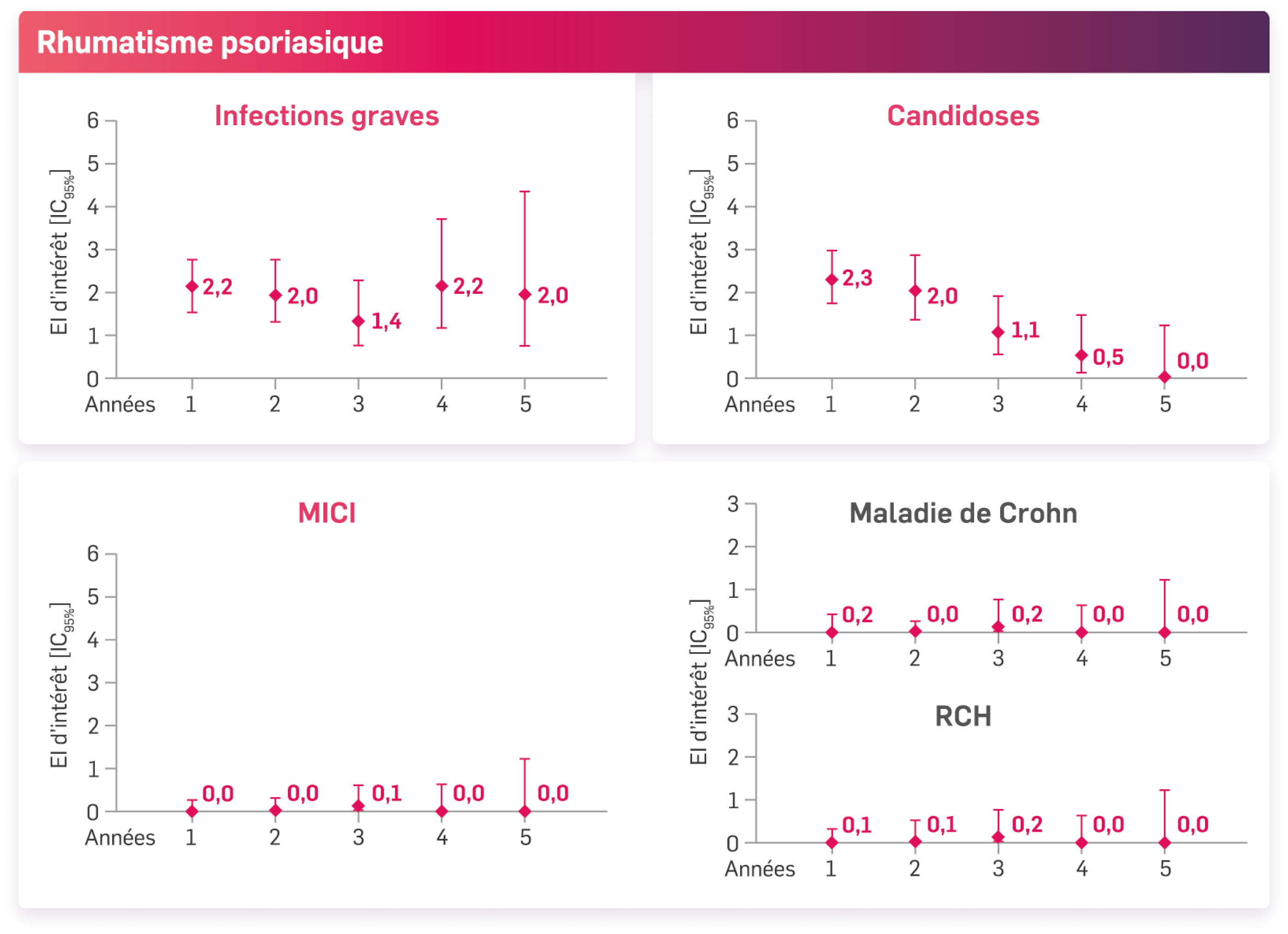
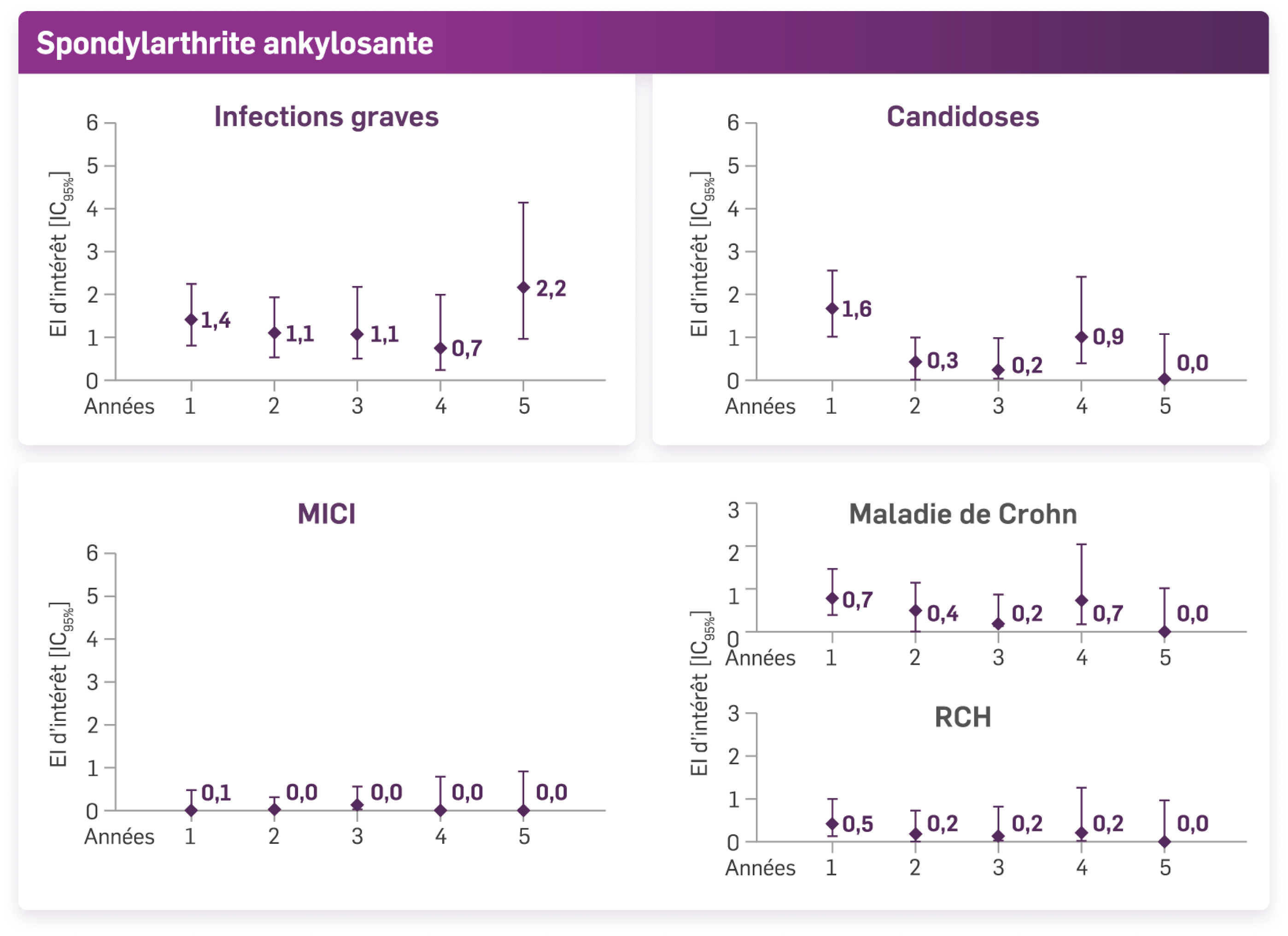
Les infections graves, les candidoses et les MICI (maladie de Crohn & rectocolite hémorragique) n’ont pas augmenté année après année avec le traitement par Cosentyx® dans les études sur le rhumatisme psoriasique et la spondylarthrite ankylosante.
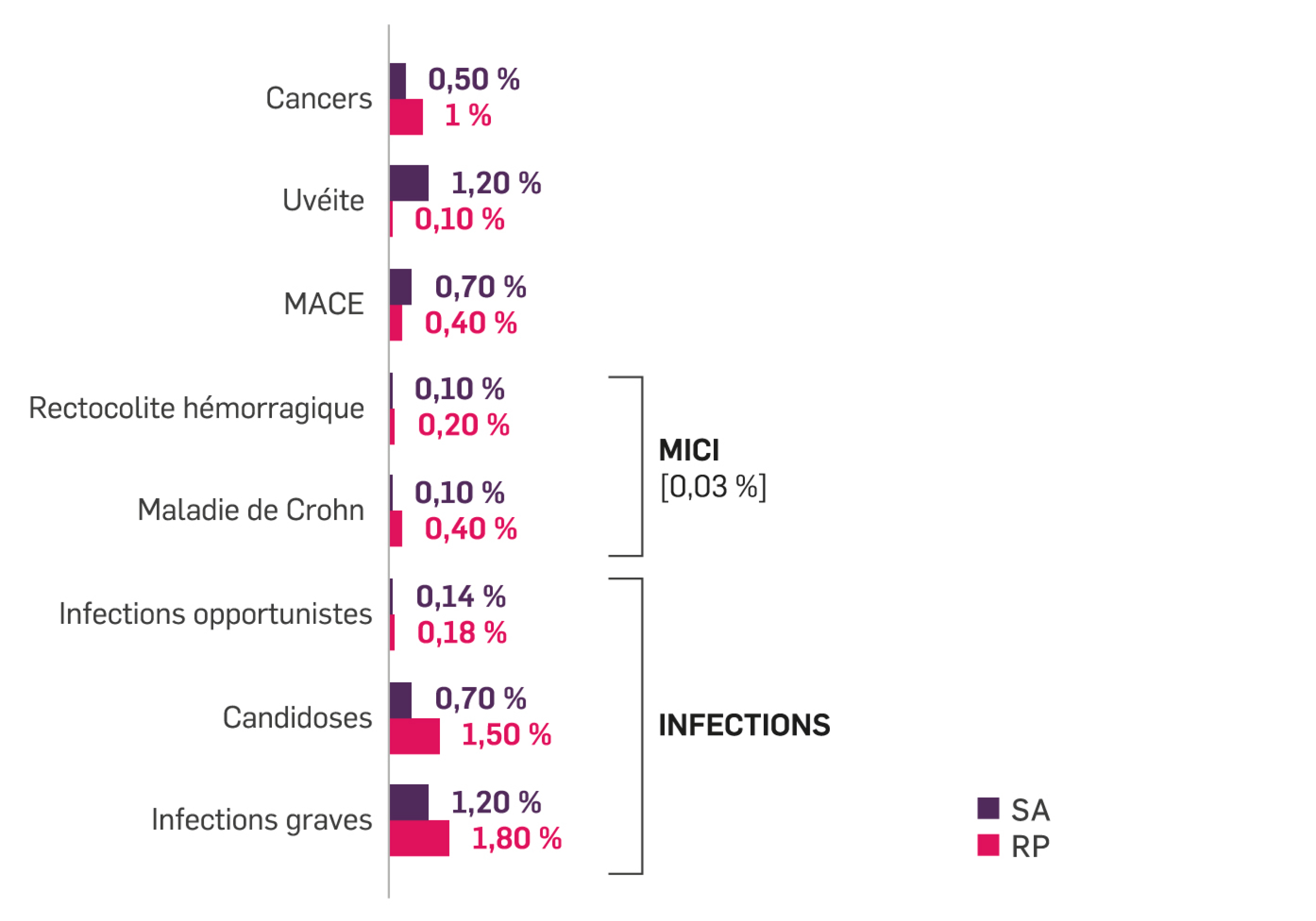
L’analyse EARR des données de surveillance de la sécurité post-commercialisation de Cosentyx® faite sur une exposition cumulée de 285 811 patients-année est conforme au profil de sécurité rapporté lors des études cliniques : infections et infestations 5,2 % patients-année, infections graves 1,4 % patients-année, MICI 0,2 % patients-année, cancers 0,3 % patients-année, MACE 0,2 % patients-année, idées et comportements suicidaires 0,04% patients-année.