Critère exploratoire :
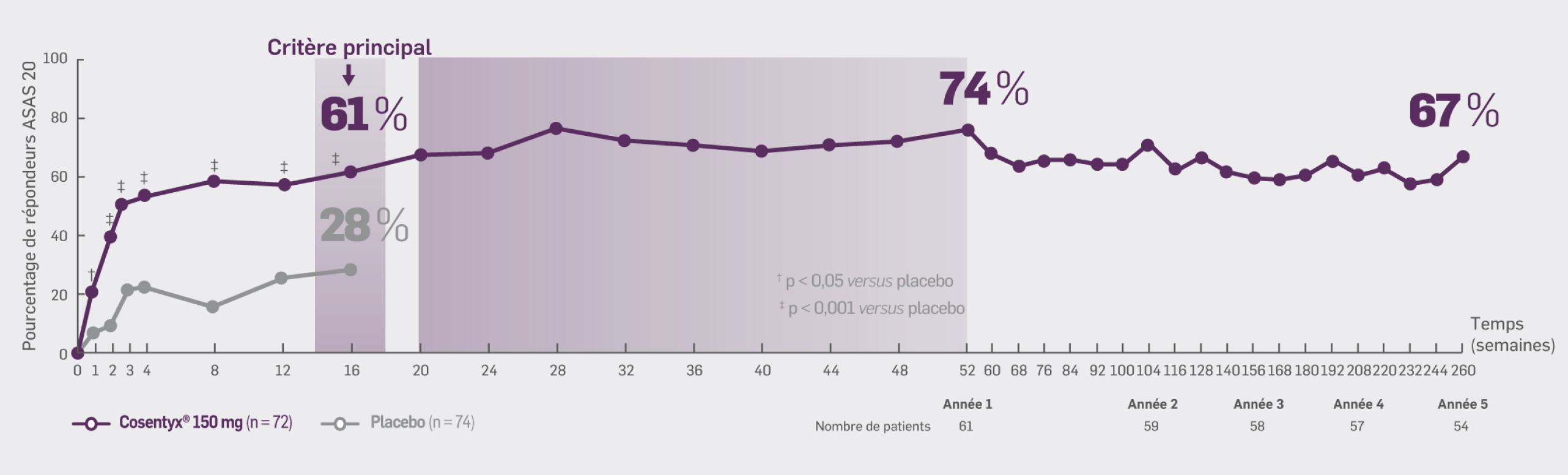
Avec Cosentyx® 150 mg à S260 :
67 % des patients initialement randomisés dans le groupe Cosentyx® 150 mg ont obtenu une réponse ASAS 20
70 % des patients traités par Cosentyx® 150 mg (y compris les patients provenant du groupe placebo ou les patients dont la dose a été augmentée)
ont obtenu une réponse ASAS 20
Critère secondaire hiérarchisé :
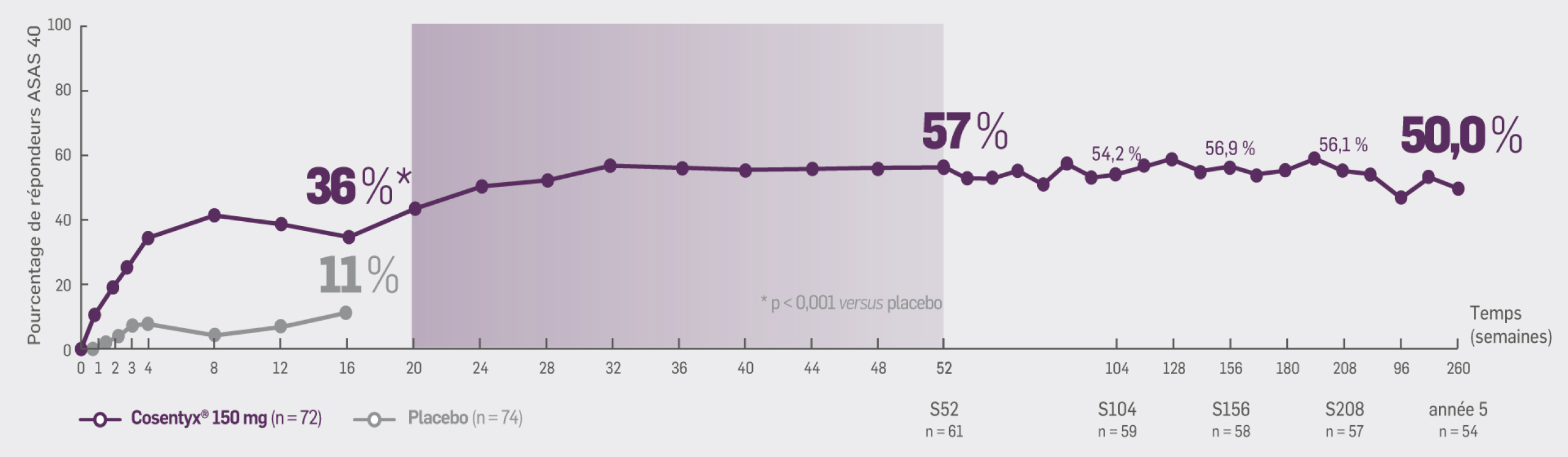
Avec Cosentyx® 150 mg à S16 :
36,1 %* des patients ont obtenu une réponse ASAS 40
OR [IC95 %] : 5,07 [2,06 ; 12,44] ; * p < 0,001 versus placebo
Critère exploratoire :
Avec Cosentyx® 150 mg à S260 :
50 % des patients initialement randomisés dans le groupe Cosentyx® 150 mg ont obtenu une réponse ASAS 40
54 % des patients traités par Cosentyx® 150 mg (y compris les patients provenant du groupe placebo ou les patients dont la dose a été augmentée)
ont obtenu une réponse ASAS 40
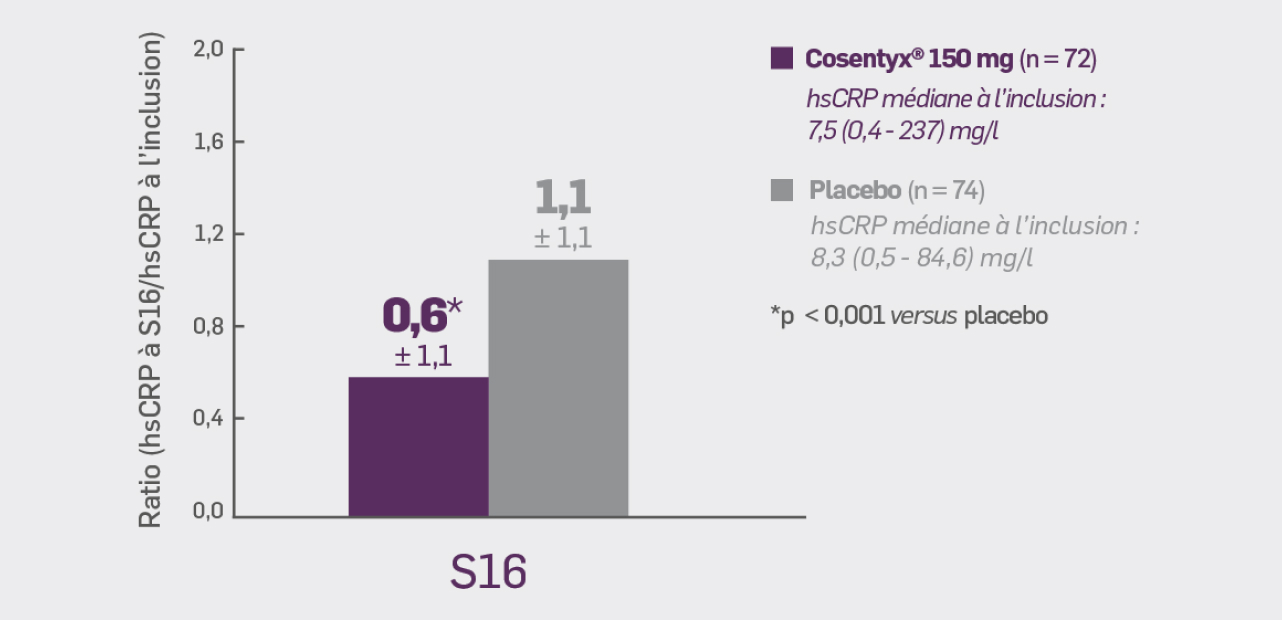
Critère secondaire hiérarchisé :
Avec Cosentyx® 150 mg à S16 :
le rapport du taux de hsCRP S16/inclusion était de + 0,55* (± 1,10)
* p < 0,001 versus placebo
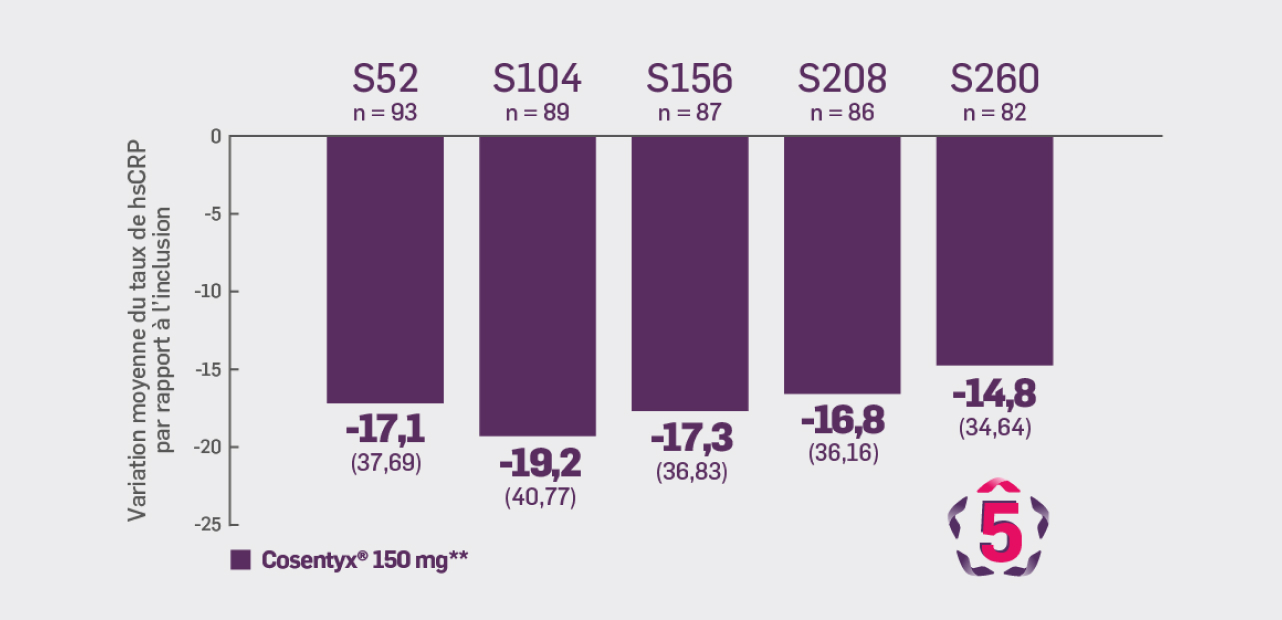
Critère exploratoire :
Avec Cosentyx® 150 mg à S260 :
une variation moyenne du taux de hsCRP de -14,8 ± 34,64
Critère secondaire hiérarchisé :
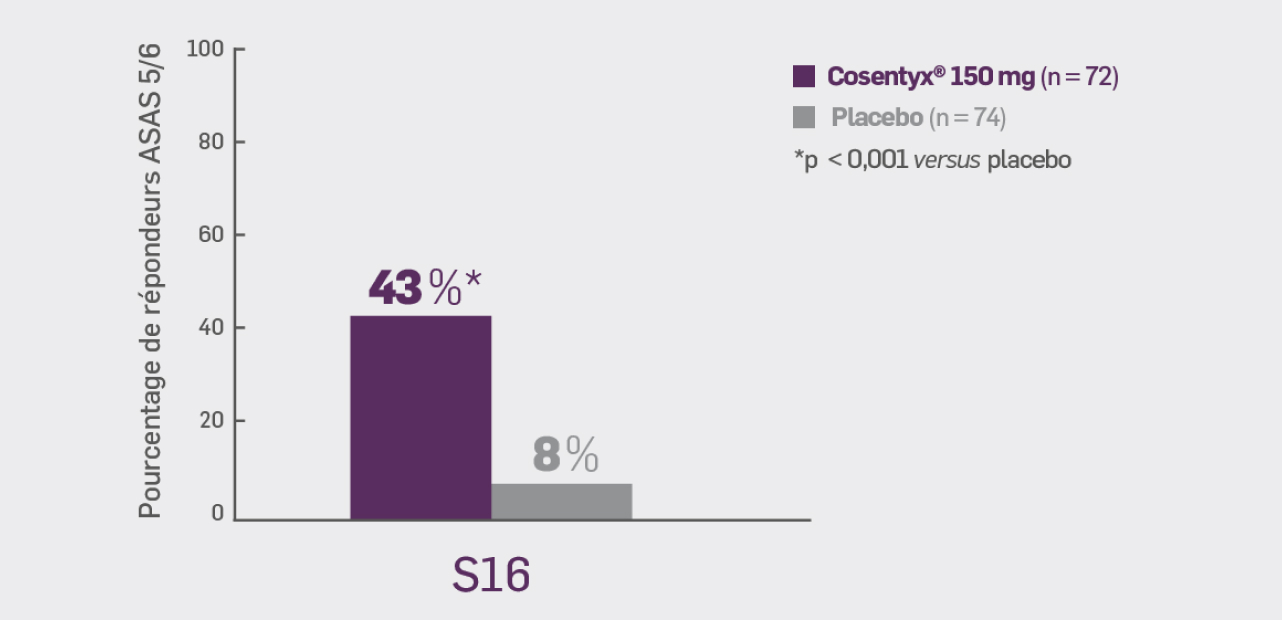
Avec Cosentyx® 150 mg à S16 :
43,1 %* des patients ont obtenu une réponse ASAS 5/6*
OR [IC95 %] : 9,15 [3,47 ; 24,12] ; * p < 0,001 versus placebo
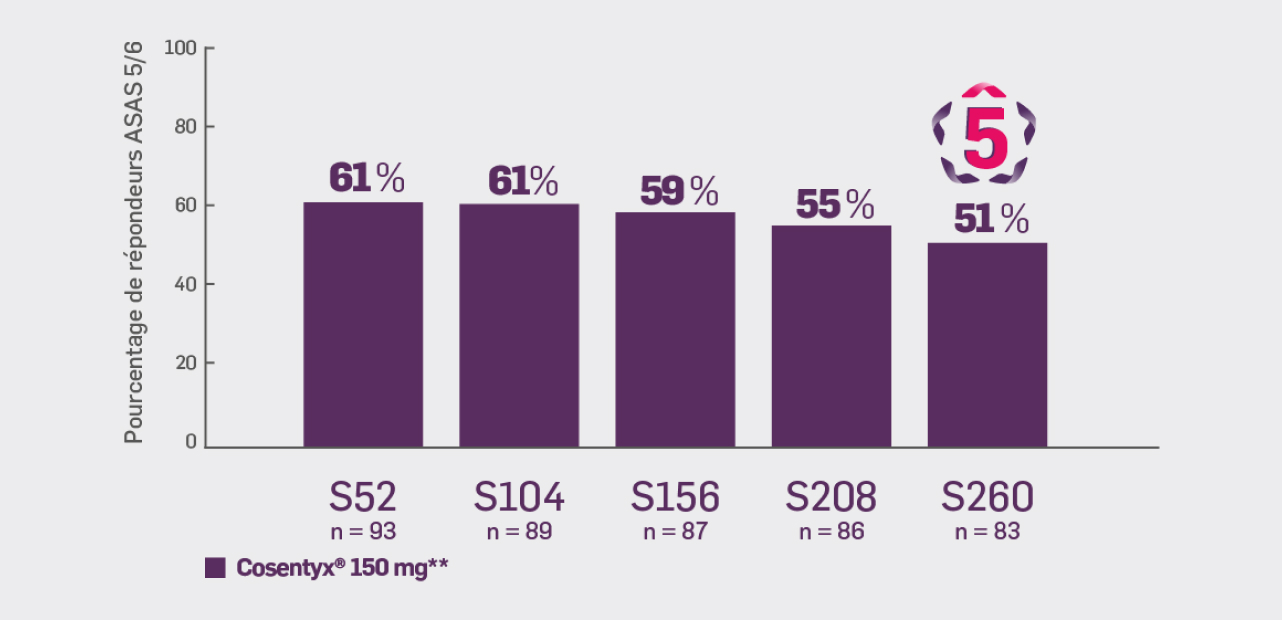
Critère exploratoire :
Avec Cosentyx® 150 mg à S260 :
51 % des patients ont obtenu une réponse ASAS 5/6
Critère secondaire hiérarchisé :
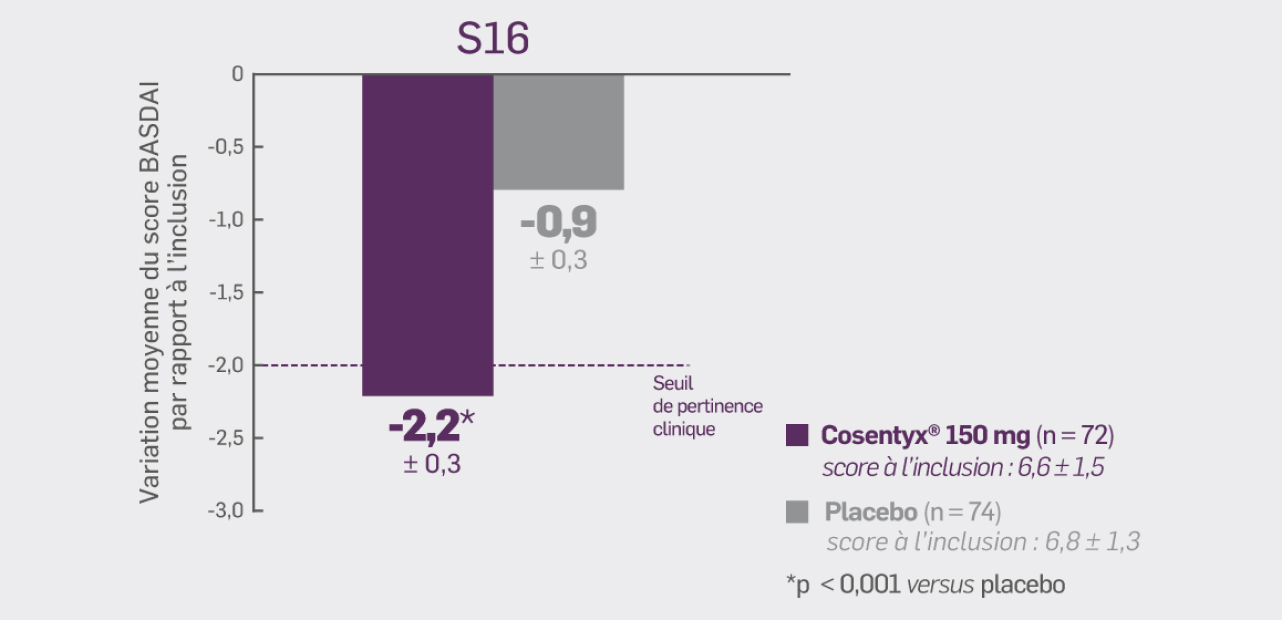
Avec Cosentyx® 150 mg à S16 :
La variation moyenne du score BASDAI par rapport à l’inclusion était de - 2,19* (± 0,25)
Δ [IC95 %] : 1,34 [-2,04 ; -0,65] ; * p < 0,001 versus placebo
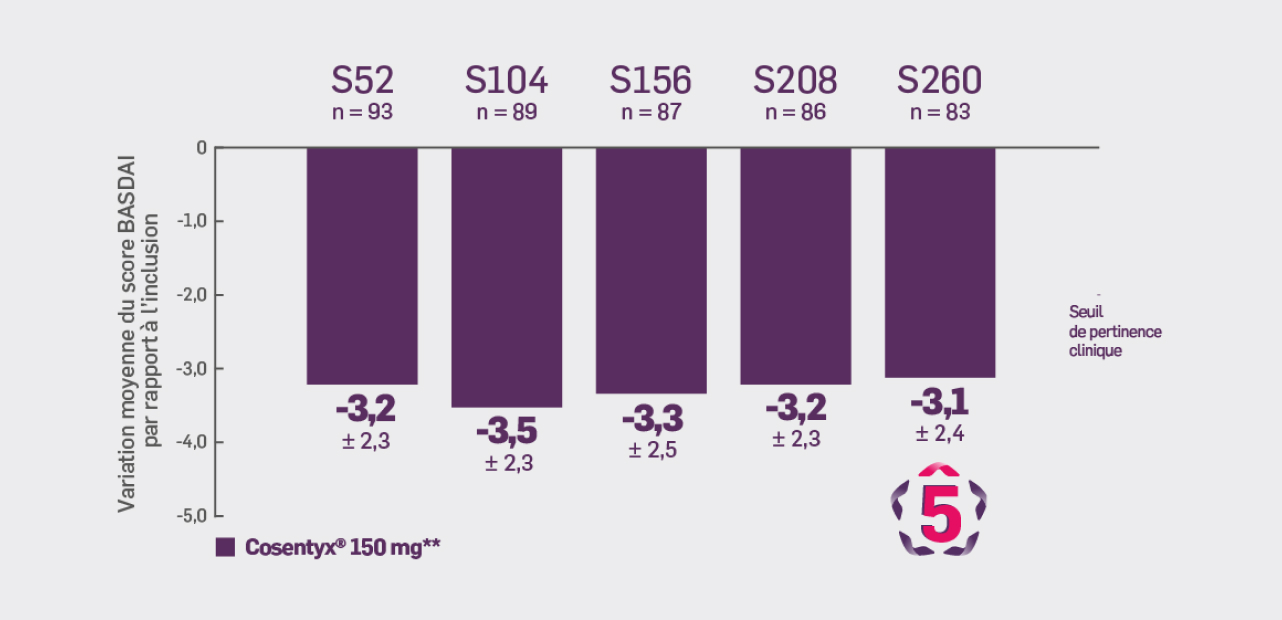
Critère exploratoire :
Avec Cosentyx® 150 mg à S260 :
une variation moyenne du score BASDAI de -3,1 ± 2,44
Critère secondaire hiérarchisé :
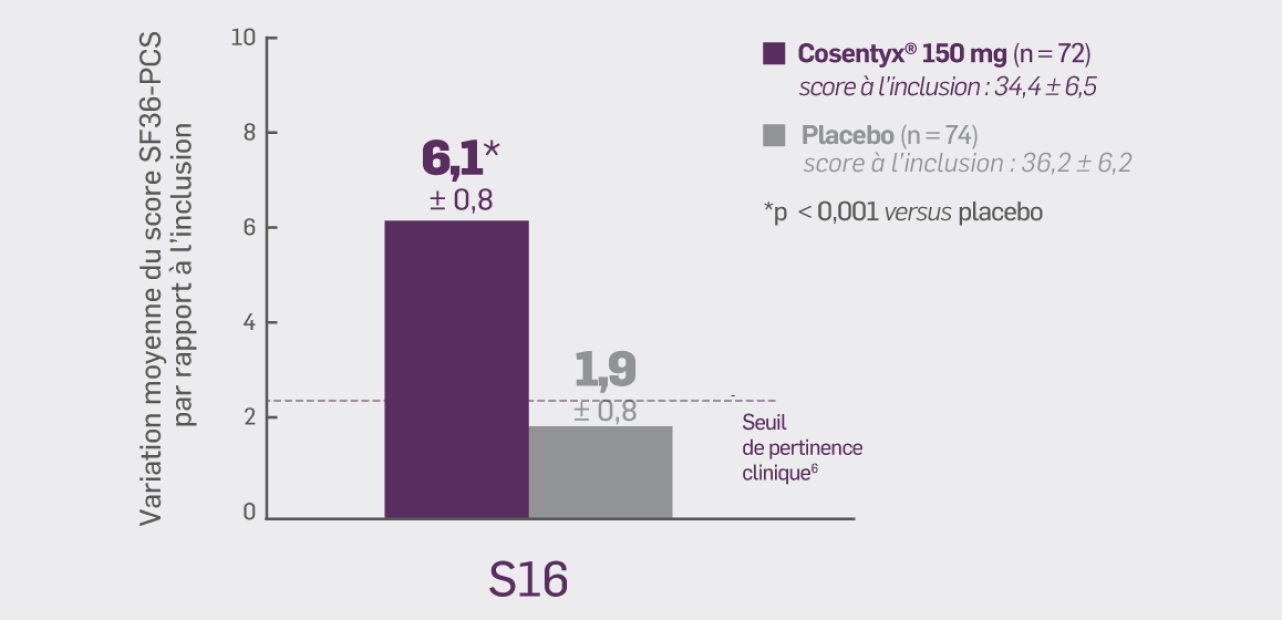
Avec Cosentyx® 150 mg à S16 :
la variation moyenne par rapport à l’inclusion du score SF36-PCS était de 6,06* (± 0,78)
Δ [IC95 %] : 4,14 [1,96 ; 6,32] ; * p < 0,001 versus placebo
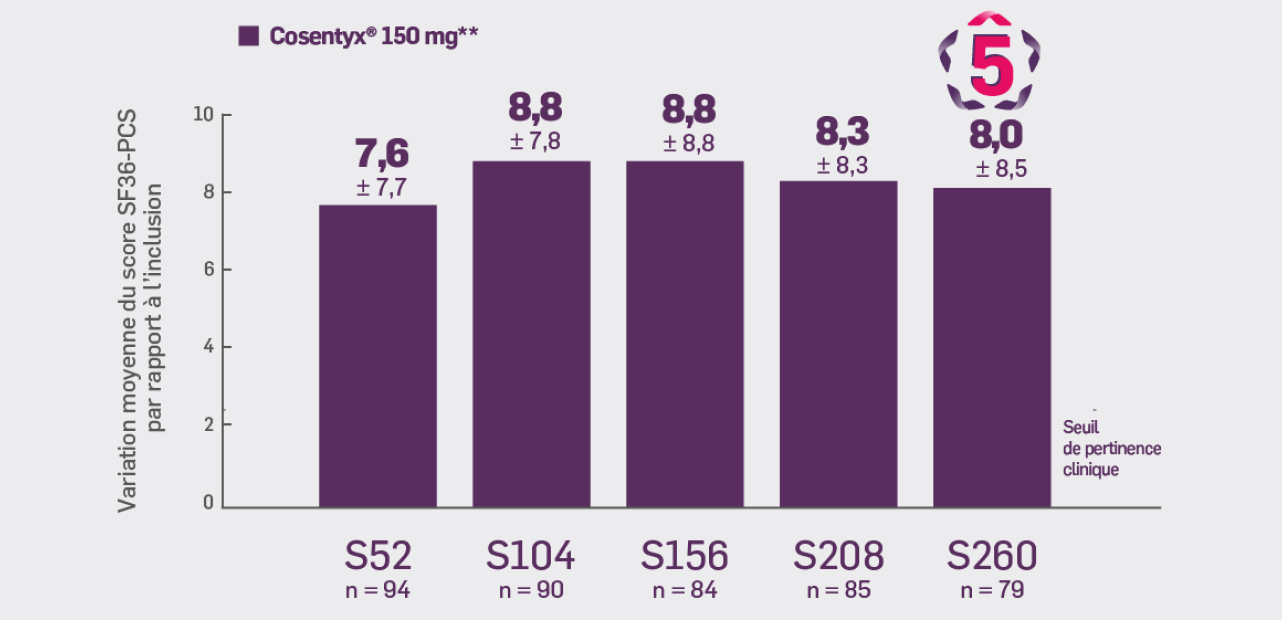
Critère exploratoire :
Avec Cosentyx® 150 mg à S260 :
une variation moyenne du score SF36-PCS de 8,0 ± 8,49
Critère secondaire hiérarchisé :
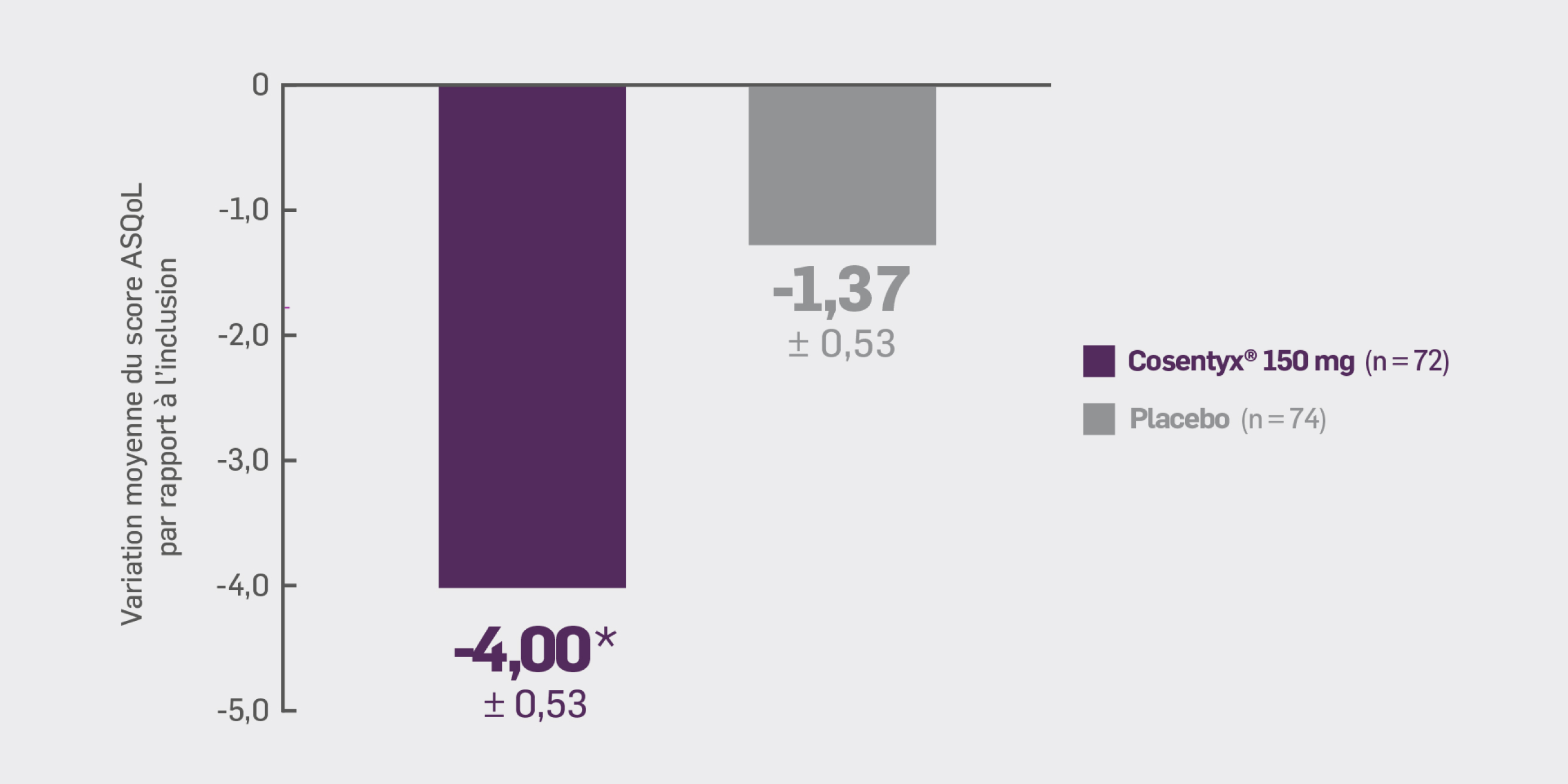
Avec Cosentyx® 150 mg à S16 :
la variation moyenne par rapport à l’inclusion du score ASQoL était de -4,00* (± 0,53)
Δ [IC95 %] : 2,63 [-4,09 ; -1,16] ; * p < 0,01 versus placebo
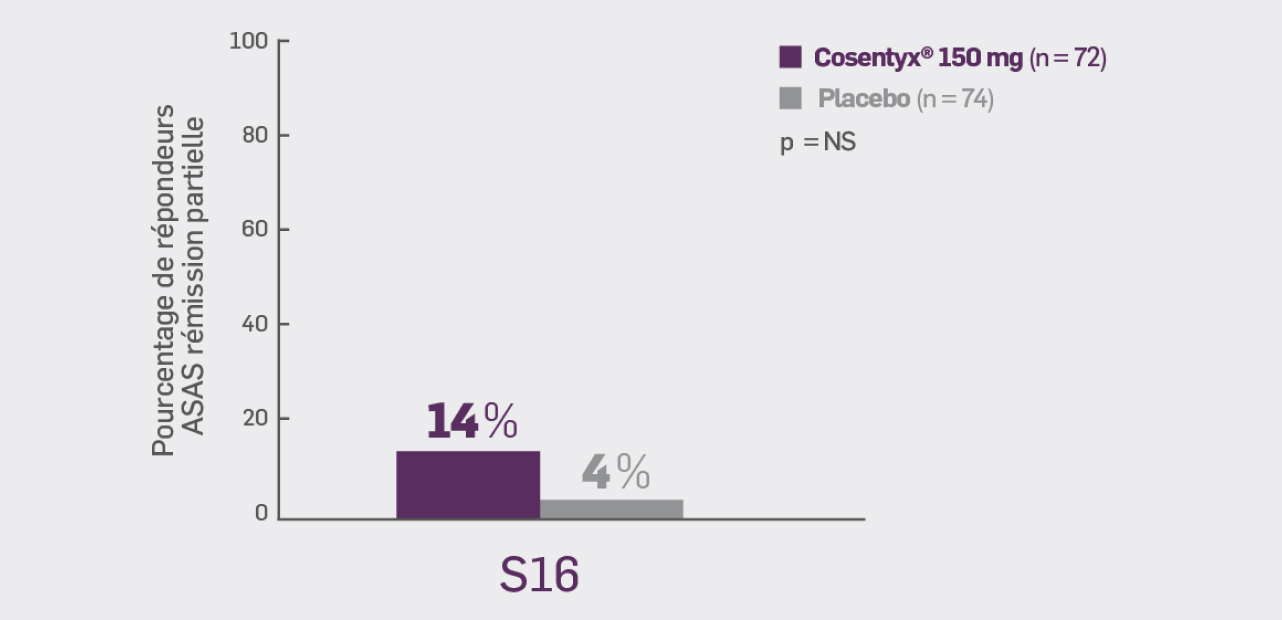
Critère secondaire hiérarchisé :
Avec Cosentyx® 150 mg à S16 :
13,9 %* des patients ont obtenu une réponse ASAS rémission partielle
OR [IC95 %] : 4,28 [1,13 ; 16,21] ; * p non significatif versus placebo
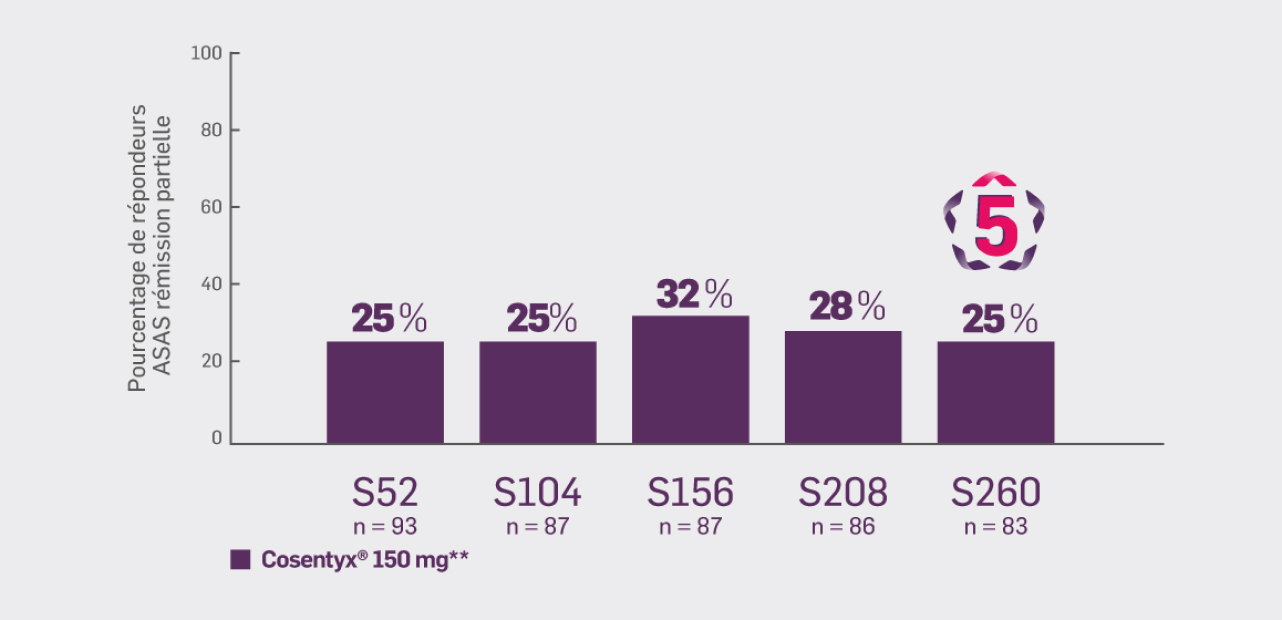
Critère exploratoire :
Avec Cosentyx® 150 mg à S260 :
25 % des patients ont obtenu une réponse ASAS rémission partielle