Critère exploratoire :
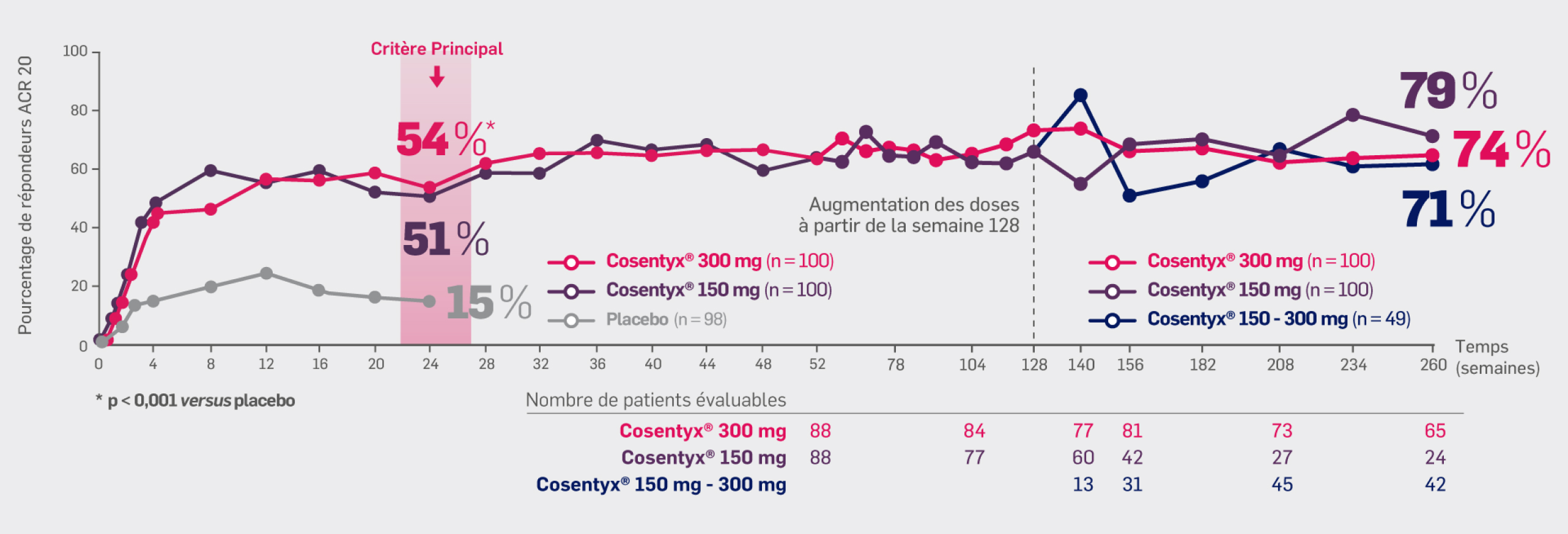
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S260 :
79% et 74% à S260 : des patients initialement randomisés dans un des groupes Cosentyx® (y compris les patients dont la dose a été augmentée)
ont obtenu une réponse ACR 20
70% et 74% de tous les patients recevant Cosentyx® (les patients initialement randomisés pour recevoir Cosentyx® et les patients du groupe placebo qui ont été randomisés pour recevoir Cosentyx®) ont obtenu une réponse ACR 20
PASI 75
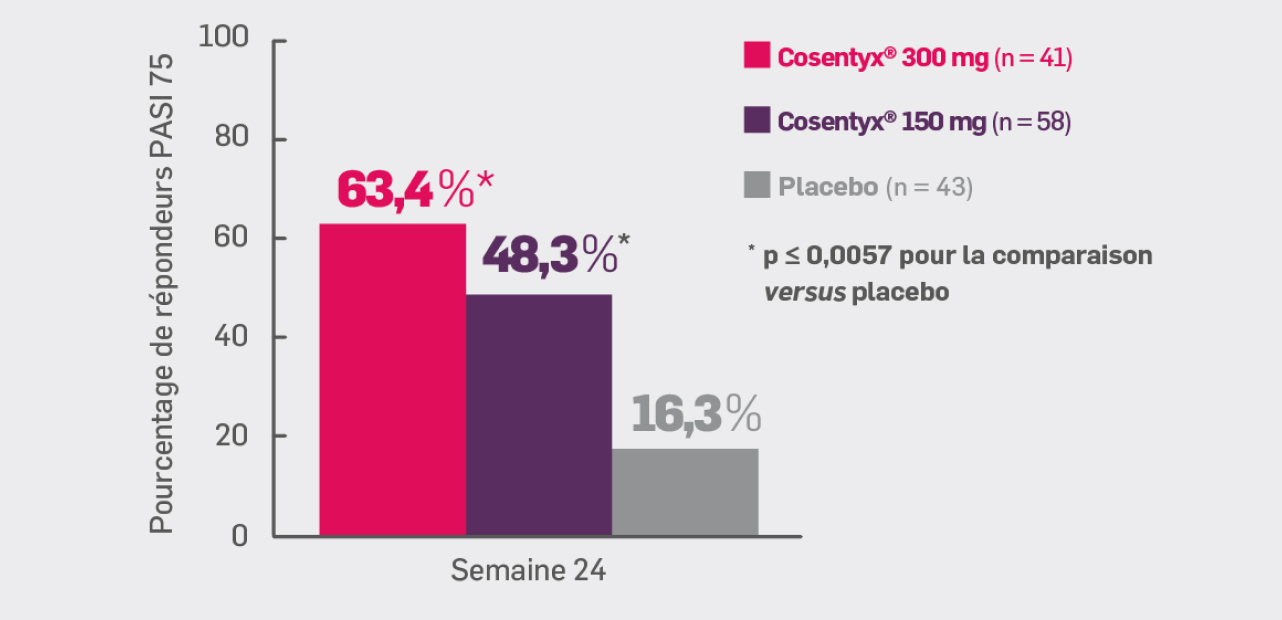
Critère secondaire hiérarchisé :
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S24 :
48,3%* et 63,4%# des patients ont respectivement obtenu une réponse PASI 75
* OR [IC95 % : 5,70 [2,12 ; 15,34] ; p ≤ 0,0017 versus placebo
# OR [IC95 % : 9,48 [3,33 ; 27,00] ; p ≤ 0,0001 versus placebo
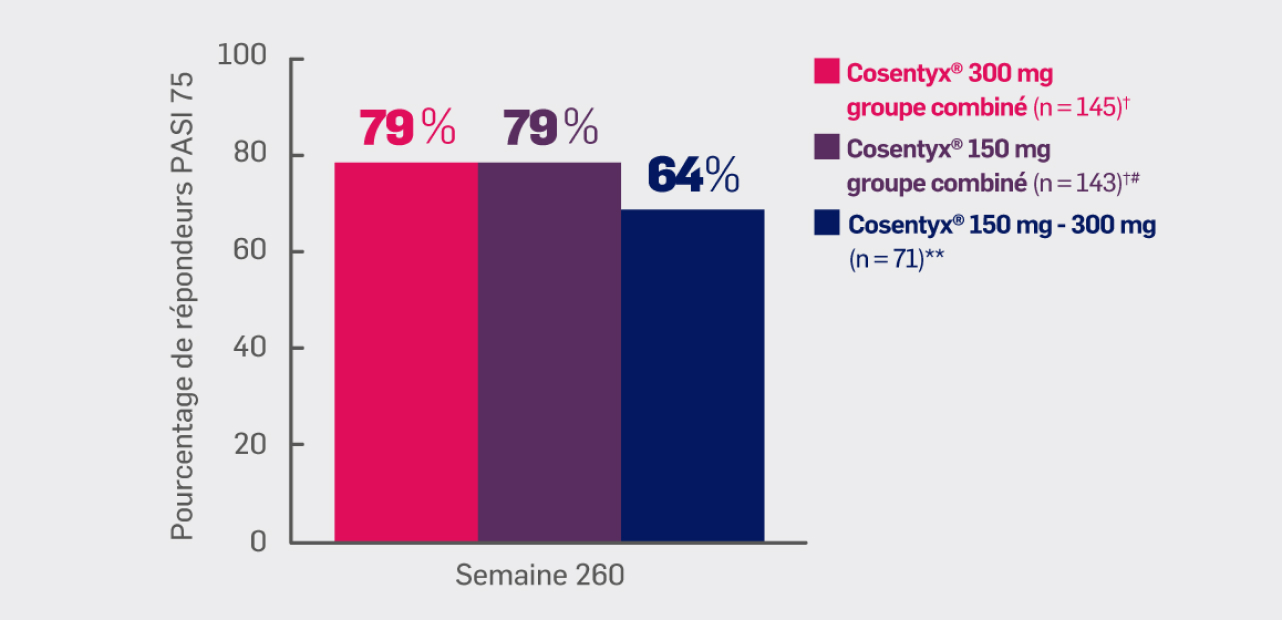
Critère exploratoire :
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S260 :
79% et 79% des patients ont obtenu une réponse PASI 75
PASI 90
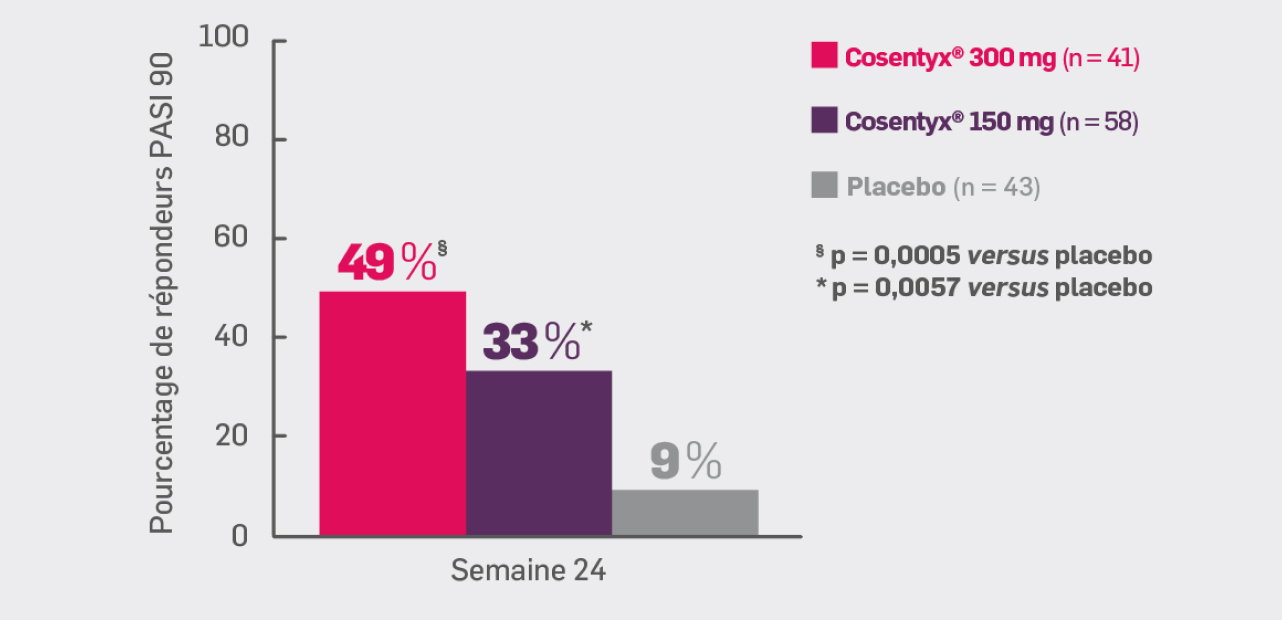
Critère secondaire hiérarchisé :
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S24 :
32,8* et + 48,8# respectivement obtenu une réponse PASI 90
* OR [IC95 % : 6,36 [1,89 ; 21,47] ; p ≤ 0,0057 versus placebo
# OR [IC95 % : 10,74 [3,13 ; 36,84] ; p ≤ 0,0005 versus placebo
Critère exploratoire :
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S260 :
67% et 64% des patients ont obtenu une réponse PASI 90
Critère secondaire hiérarchisé :
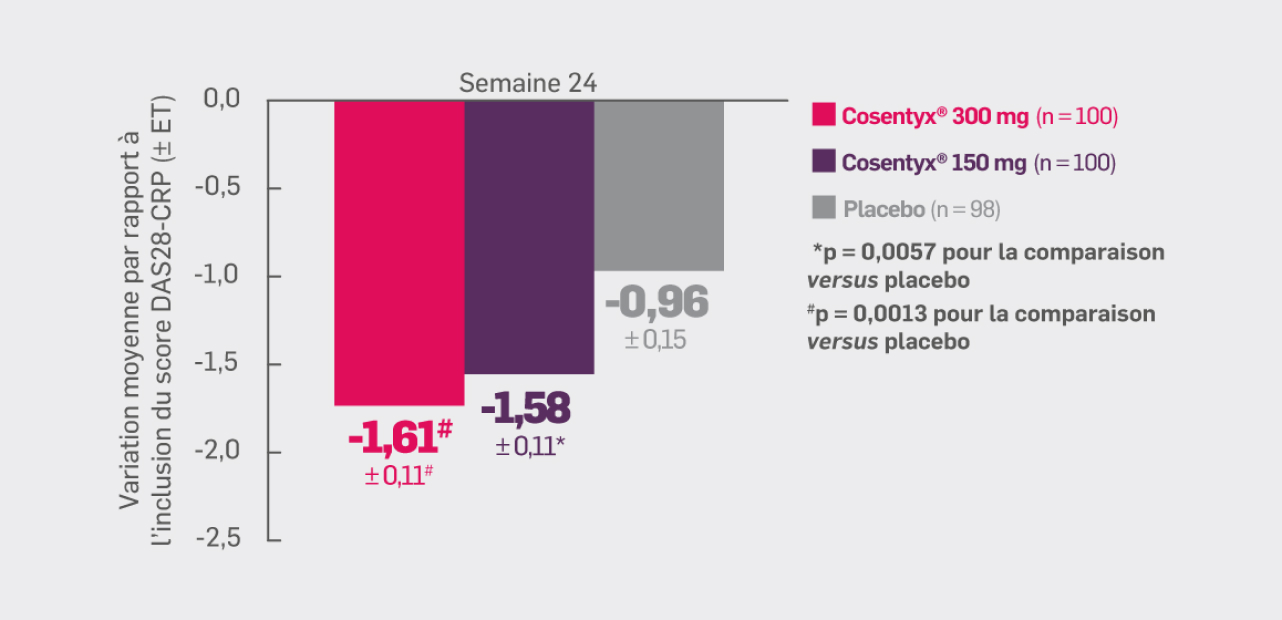
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S24 :
les patients ont présenté une amélioration du score DAS28-CRP
par rapport à l’inclusion -1,58† et -1,61#, respectivement
† OR [IC95 % : -0,62 [-0,98 ; -0,26] ; p ≤ 0,0057 versus placebo
# OR [IC95 % : -0,65 [-1,02 ; -0,29] ; p = 0,0013 versus placebo
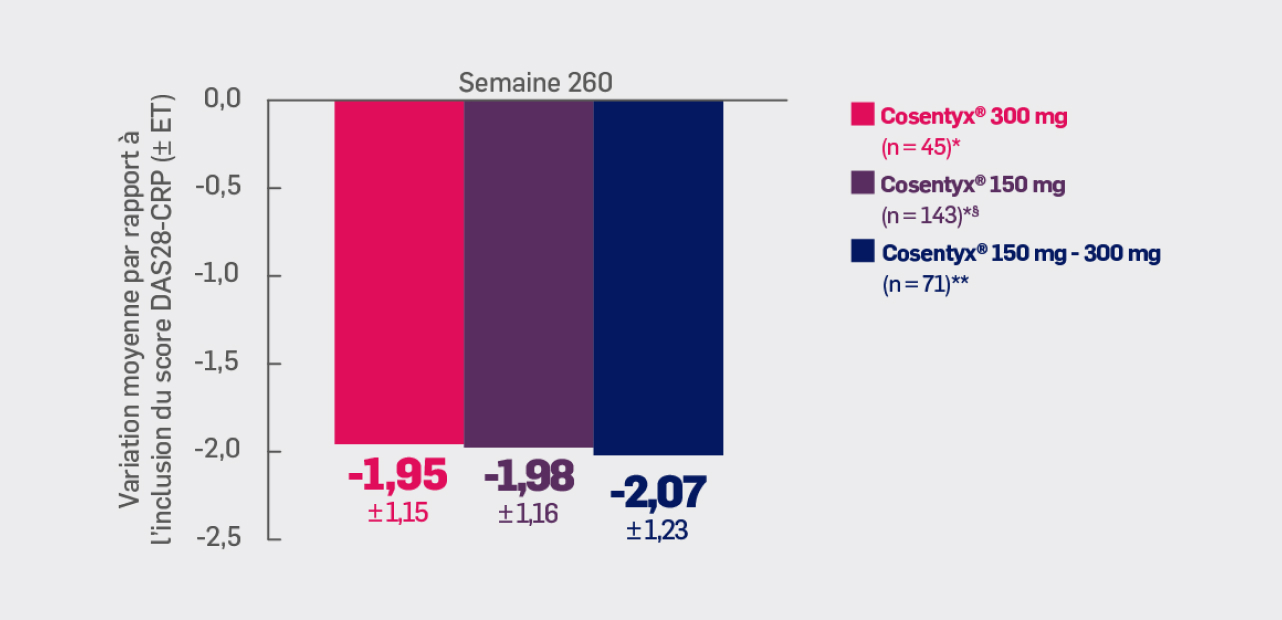
Critère exploratoire :
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S260 :
une variation moyenne du score DAS28-CRP de -1,98 ± 1,16 et -1,95 ± 1,15
Critère secondaire hiérarchisé :
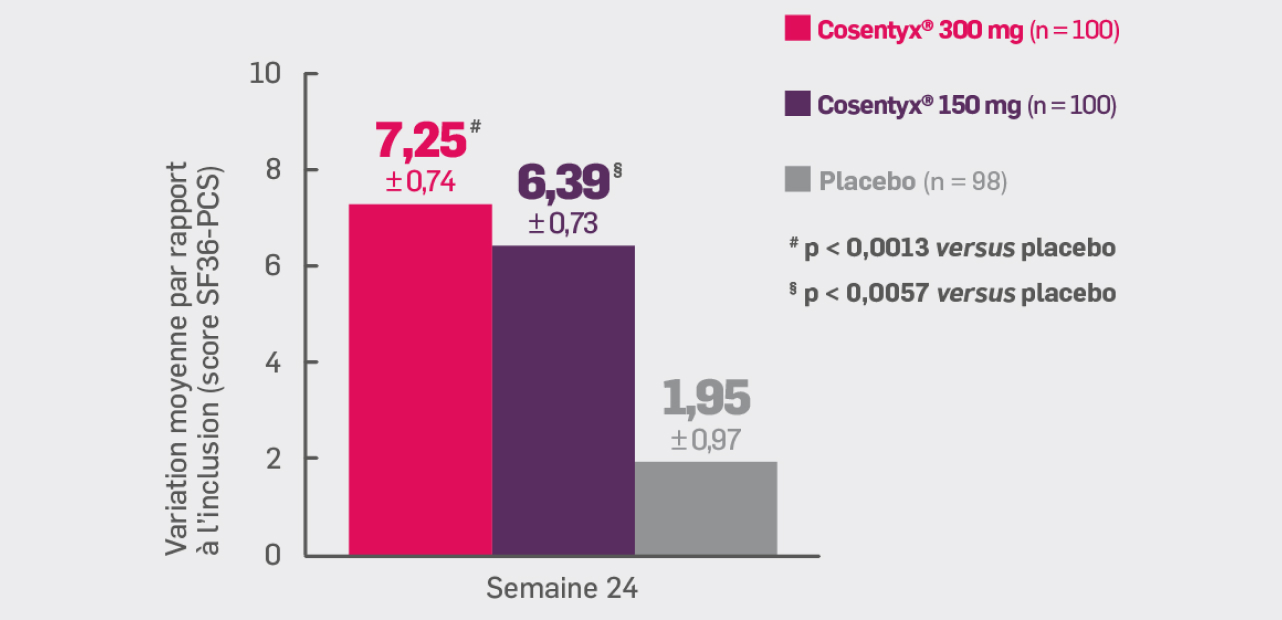
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S24 :
les patients ont présenté une amélioration du score SF36-PCS
par rapport à l’inclusion de + 6,39† et +7,25#, respectivement
† OR [IC95 % : 4,44 [2,05 ; 6,83] ; p = 0,0057 versus placebo
# OR [IC95 % : 5,30 [2,91 ; 7,69] ; p < 0,0013 versus placebo
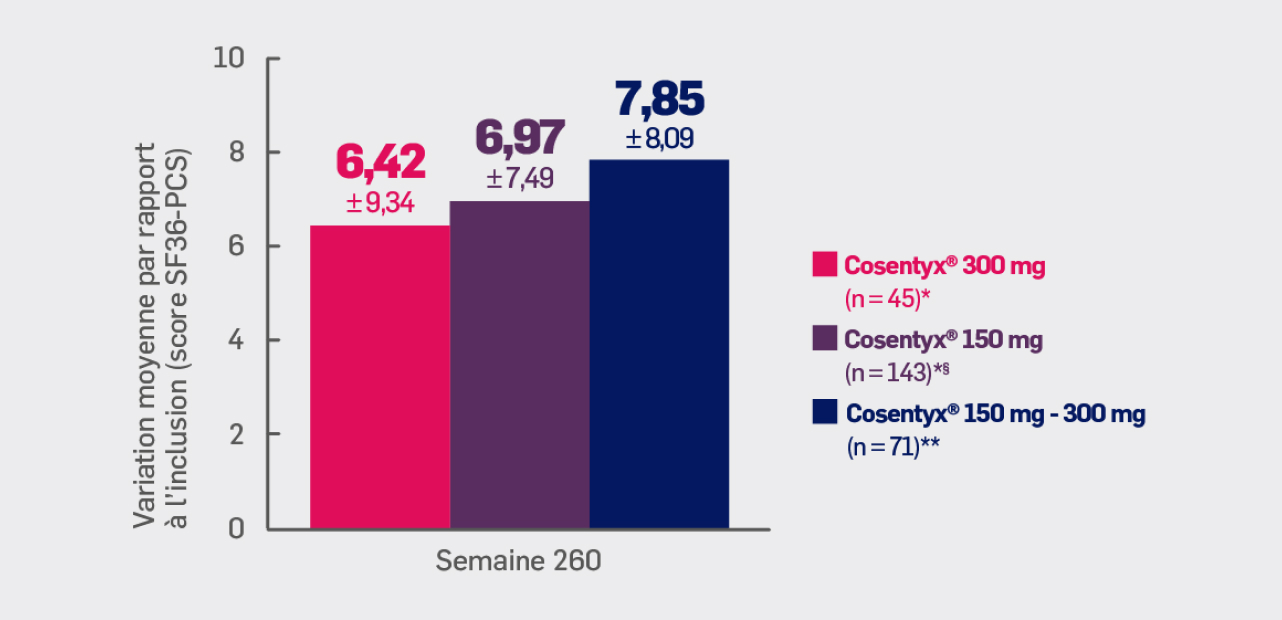
Critère exploratoire :
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S260 :
une variation moyenne du score SF36-PCS de 6,97 ± 7,49 et 6,42 ± 9,34
Critère secondaire hiérarchisé :
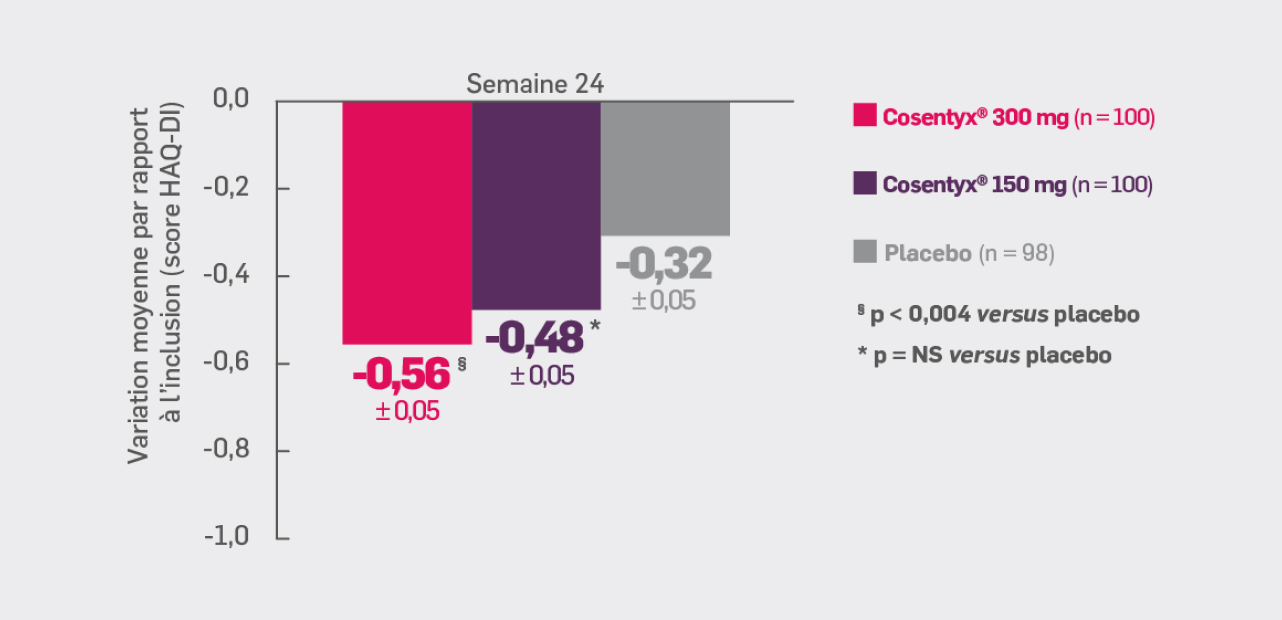
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S24 :
les patients ont présenté une amélioration du score HAQ-DI
par rapport à l’inclusion de -0,48† et -0,56#, respectivement
† OR [IC95 % : -0,17 [-0,32 ; -0,02] ; p non significatif versus placebo
# OR [IC95 % : -0,25 [-0,40 ; -0,10] ; p = 0,004 versus placebo
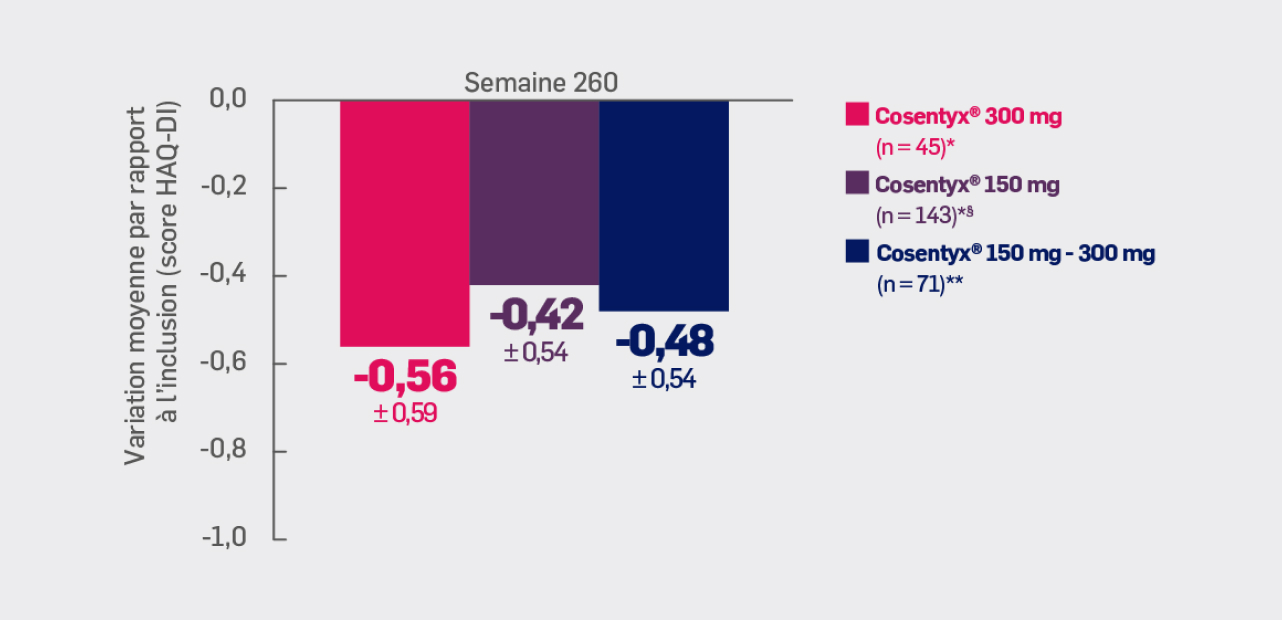
Critère exploratoire :
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S260 :
une variation moyenne du score SF36-PCS de -0,42 ± 0,54 et -0,56 ± 0,59
Critère secondaire hiérarchisé :
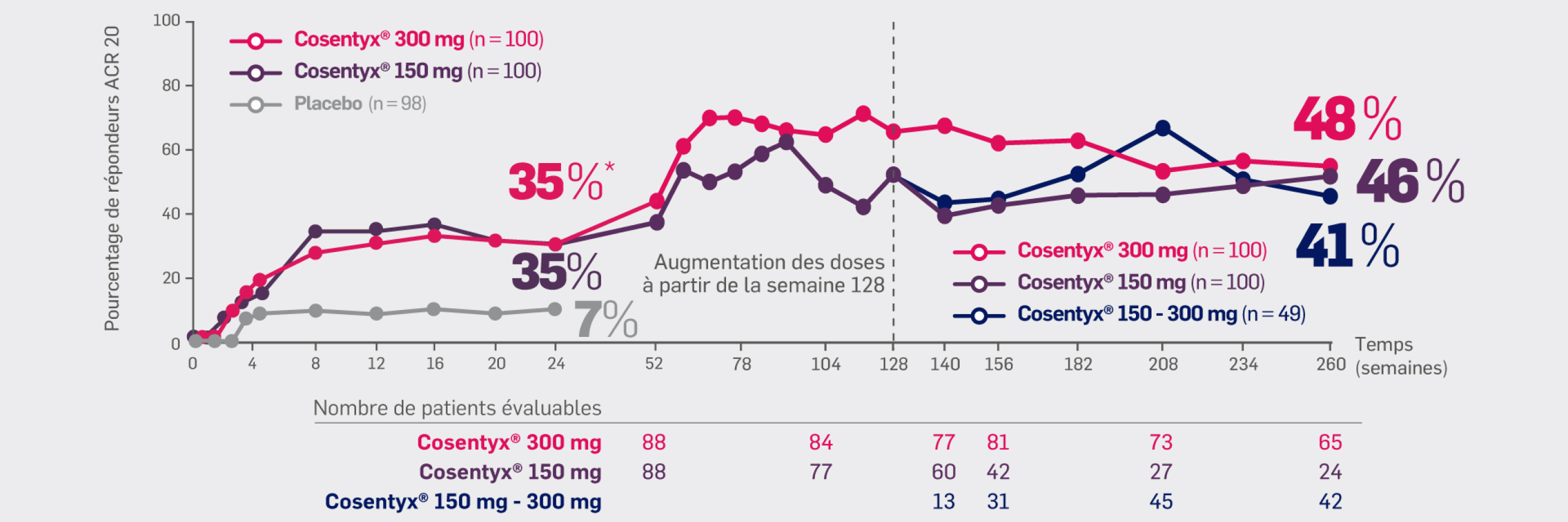
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S24 :
35 %* des patients quel que soit le dosage, ont obtenu une réponse ACR 50
* OR [IC95 % : 7,15 [2,97 ; 17,22] ; p = 0,004 versus placebo
Critère exploratoire :
Avec Cosentyx® 150 mg et Cosentyx® 300 mg à S260 :
46% et 48% des patients initialement randomisés dans un des groupes Cosentyx® (y compris les patients dont la dose a été augmentée)
ont obtenu une réponse ACR 20
43 % et 52 % de tous les patients recevant Cosentyx® (les patients initialement randomisés pour recevoir Cosentyx® et les patients du groupe placebo qui ont été randomisés pour recevoir Cosentyx®) ont obtenu une réponse ACR 20
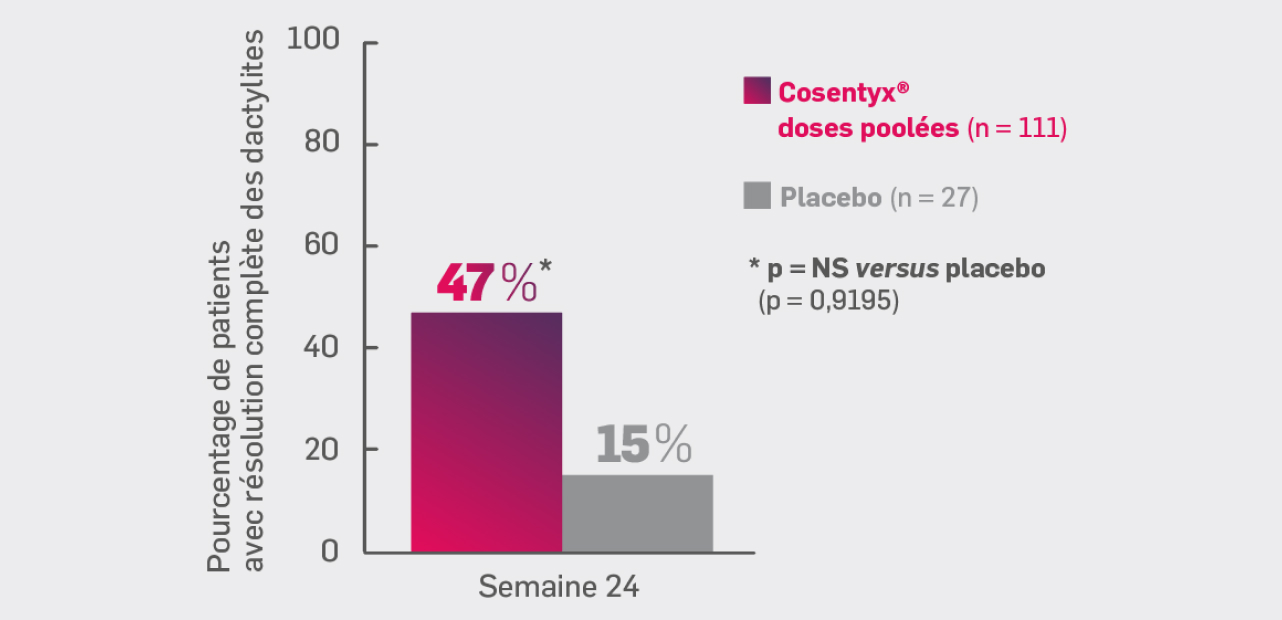
Critère secondaire hiérarchisé :
Résolution des dactylites
Cosentyx® (groupe combiné) : 47 %* - Placebo : 15 %
* OR [IC95 %] : 0,23 [0,07 ; 0,72] ; p non significatif versus placebo
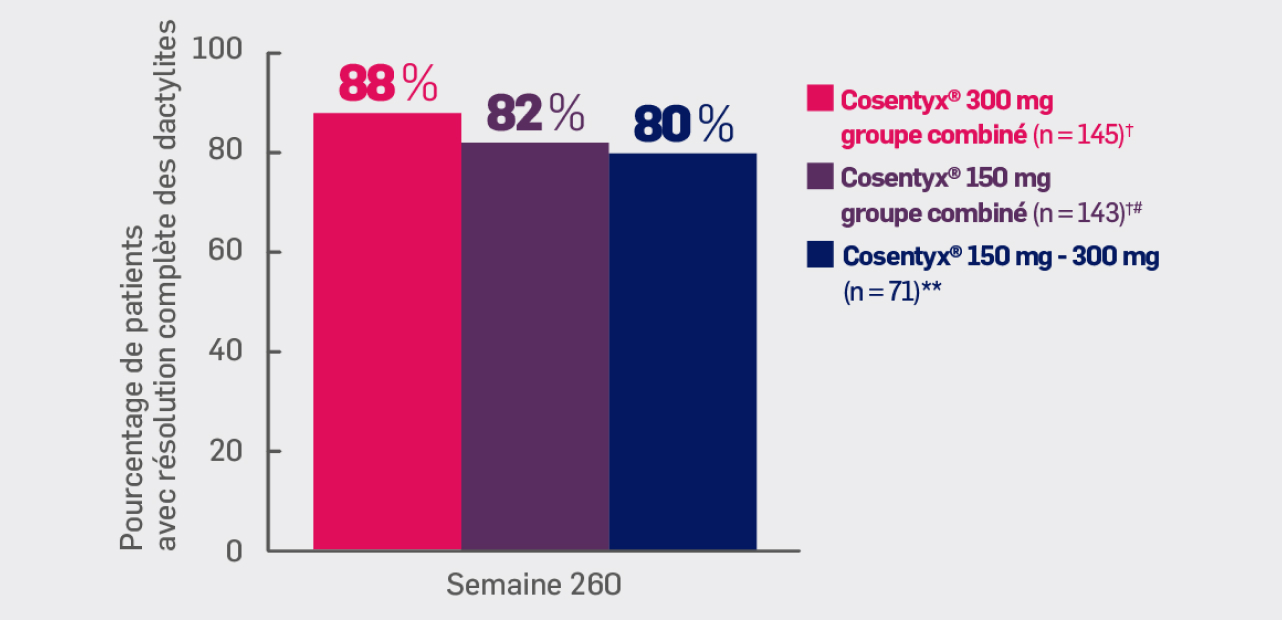
Critère exploratoire :
Avec Cosentyx® 150mg et Cosentyx® 300 mg à S260 :
82% et 88% des patients ont obtenu une résolution des dactylites
Critère secondaire hiérarchisé :
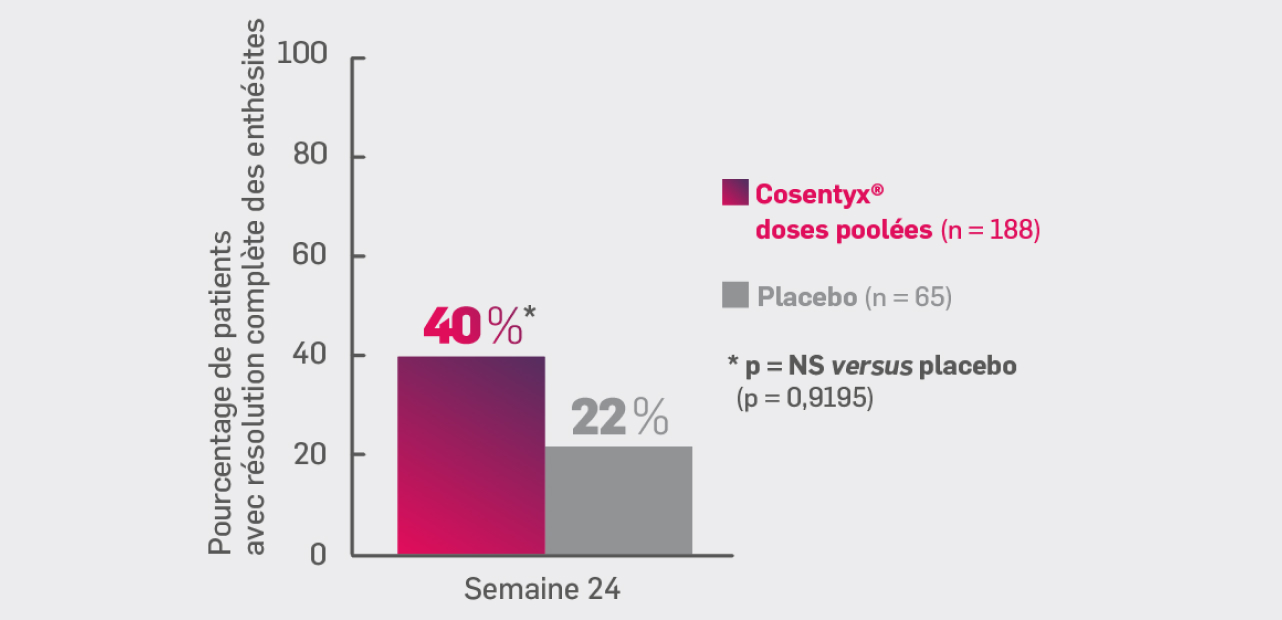
Résolution des enthésites
Cosentyx® (groupe combiné) : 40 %* - Placebo : 22 %
* OR [IC95 %] : 0,39 [0,20 ; 0,77] ; p non significatif versus placebo
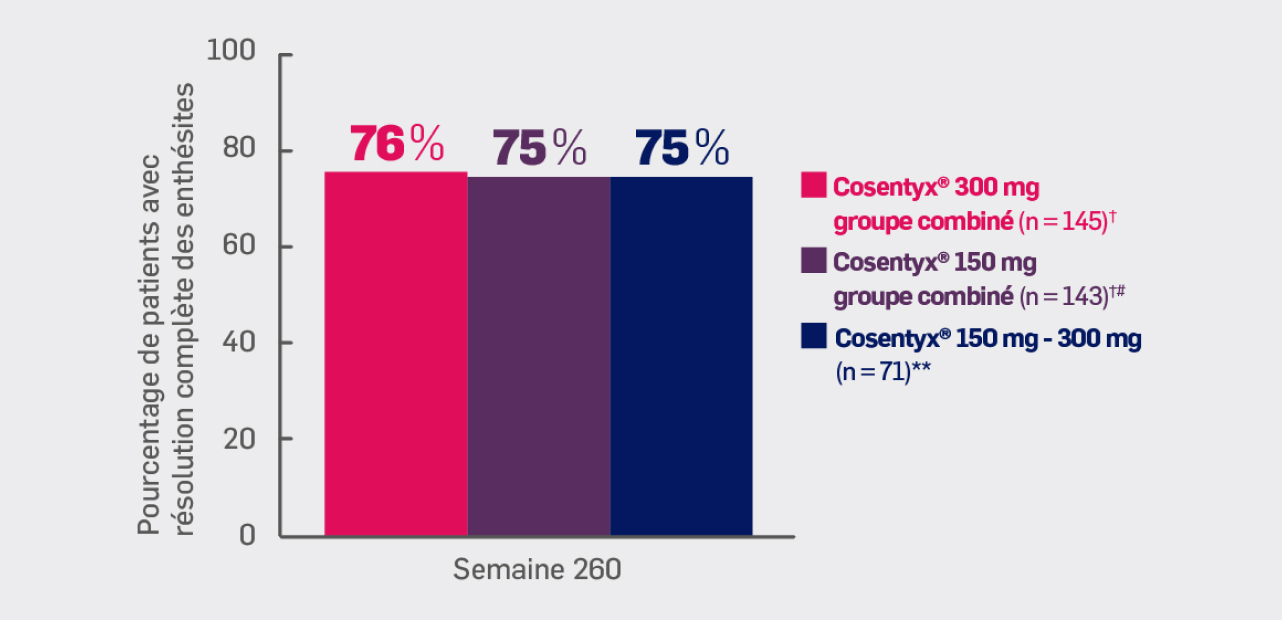
Critère exploratoire :
Avec Cosentyx® 150mg et Cosentyx® 300 mg à S260 :
75% et 76% des patients ont obtenu une résolution des enthésites